Alerta por “posible presencia” de sedantes en este medicamento: qué chequear antes de aplicarlo
La FDA ordenó el retiro del mercado de un producto del laboratorio Hikma debido a que detectaron un fármaco no autorizado
 3 minutos de lectura'
3 minutos de lectura'
Después de que Hikma comenzara a retirar del mercado un lote de inyección de acetaminofén a principios de este mes, la empresa decidió ampliar este retiro a nivel nacional y el pedido llegó hasta los consumidores.
La retirada se inició debido a la “posible presencia” de una bolsa etiquetada como inyección de dexmedetomidina HCL dentro de un paquete destinado a inyección de acetaminofén, que es un analgésico. La dexmedetomidina es un sedante frecuentemente utilizado antes o durante procedimientos quirúrgicos, informa la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés).
La administración accidental de dexmedetomidina en lugar de acetaminofén podría causar “diversos grados” de sedación en los pacientes, así como respiración y ritmo cardíaco lentos, variaciones en la presión arterial y “resultados potencialmente mortales”, según advirtió la misma compañía en un comunicado.
Hasta el momento, la empresa ha recibido un solo reporte de un evento adverso relacionado con este problema.
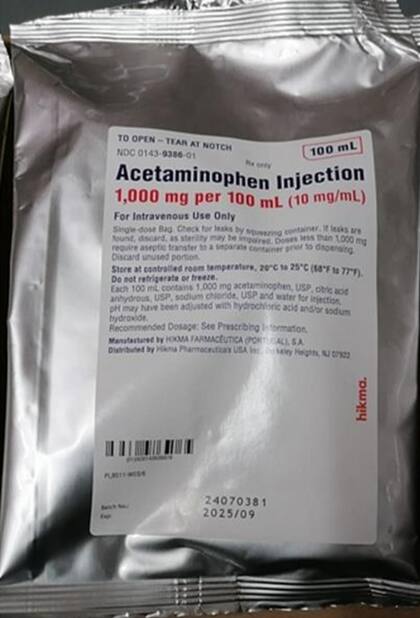
El lote afectado fue producido en marzo y tiene fecha de vencimiento en septiembre de 2025. Hikma inicialmente solicitó a sus clientes directos que retiraran el producto de la distribución el pasado 8 de julio; pero ahora ha extendido la medida al nivel de consumidor. La empresa le solicitó a los clientes de centros médicos que identifiquen, retiren y devuelvan el producto en cuestión.
La inyección de acetaminofén se utiliza para el control del dolor leve a moderado, reducir la fiebre y aliviar el dolor moderado a intenso en combinación con analgésicos opioides en pacientes mayores de 2 años. La solución intravenosa retirada del mercado se vende en bolsas de 100 ml con una concentración de 1000 mg por 100 ml (10 mg/ml).
Cómo saber si tengo el producto en cuestión
Para consultas sobre el retiro de productos del mercado, Hikma pide comunicarse con el laboratorio, por teléfono al 877-890-0765 (de lunes a viernes, de 9 a. m. a 5 p. m., hora del Este de EE.UU.) o por correo electrónico a rxrecalls@inmar.com.
La FDA enfatiza que los consumidores deben comunicarse con su médico o proveedor de atención médica si “han experimentado cualquier problema que pueda estar relacionado con la toma o uso de este medicamento”.

Las reacciones adversas o los problemas experimentados con el uso de este producto pueden denunciarse al programa de informes de eventos adversos MedWatch de la FDA, ya sea en línea, por correo postal o por fax. También se puede llamar al 1-800-332-1088 y solicitar un formulario de informe, luego se completa y se envía a la dirección que figura en el formulario con la dirección ya impresa, o por fax al 1-800-FDA-0178
Otras noticias de FDA
Vendido en 14 estados. El popular condimento fue retirado de las tiendas a solo dos semanas de Navidad
"Alto riesgo". FDA advierte sobre el mal funcionamiento de estos detectores de glucosa: "Suspendan inmediatamente su uso"
Riesgo sanitario. Alerta por retiro de burritos de desayuno enviados a escuelas de EE.UU. que podrían estar contaminados
 1
1Controversia en Arizona: la decisión de una alcaldesa de origen latino de retirar cámaras de seguridad por temor al ICE
- 2
Trump mide el apoyo político a su guerra en Irán en el Congreso en un clima de profundas divisiones
 3
3Niña prodigio en California: tiene 10 años, se apellida igual que un personaje de The Big Bang Theory y ya estudia en la universidad
 4
4Noticias de California: pronostican ráfagas severas en Santa Bárbara, Ventura y Los Ángeles desde este jueves